摘要
背景
着色性干皮病E组(XP-E)是XP最不常见的形式之一,这是一种罕见的综合征,患者在暴露在阳光下的区域容易患皮肤癌。XP-E患者由于表型轻微,一般在成年后才被诊断出来。病例表现:2名XP-E兄弟姐妹,女,23岁,男,25岁,来自巴西的一个近亲家庭,携带新的DDB2基因错义变体NM_000107.3:c。1027G > C,与皮肤癌早发性和重度表型相关,如角膜和耳部结节性黑色素瘤。结论:基因组变异致病性的评估是一个挑战,因为该家族属于基因组数据库中代表性不足的人群。鉴于文献记录XP-E病例的缺乏和在实现早期诊断方面遇到的挑战,本报告强调XP-E患者采取防晒措施的必要性。此外,它还强调了COVID-19大流行对癌症诊断的不利影响,导致受影响个体出现严重表型。
背景
着色性干皮病(XP)的特点是对紫外线辐射引起的晒伤、皮肤癌、眼部疾病和神经退化的敏感性增加[1]。XP患者发生黑色素瘤的风险增加2000倍,发生非黑色素瘤皮肤癌XP的风险增加10000倍[2]。XP根据突变基因分为8个遗传组:XP- a至XP- g组分别表现为XPA、ERCC3、XPC、ERCC2、DDB2、ERCC4和ERCC5基因的改变,XP- v组表现为POLH基因的突变[3]。诊断主要以临床为基础,并通过基因测试或功能细胞为基础的方法证实。
XP-E是一种罕见的疾病,在少数报道的病例中,DDB2基因的致病性变异导致DDB2(损伤特异性dna结合蛋白2,也称为p48亚基)缺失或功能失调[4,5]。人类DDB2基因位于11号染色体(11p11.2)上,由10个外显子组成,编码一个48kda的蛋白,包含427个氨基酸,仅定位于细胞核,与DDB1形成异源二聚体,形成UV-DDB复合物。DDB2在识别DNA损伤的Global Genomic Nucleotide Excision Repair (GG-NER)中起核心作用[4,6]。DDB2与嘧啶二聚体结合,包括CPD(环丁烷嘧啶二聚体)和6- 4pp(6−4嘧啶-嘧啶光产物)的异构体,具有高亲和力和特异性。
在这篇文章中,我们分享了两个兄弟姐妹引人注目的临床之旅,我们已经得到了患者和他们父母的必要同意,以展示他们的图像。这一决定背后的基本原理源于这样一个事实,即病变会影响他们的面部和眼睛区域,因此在准确描述肿瘤时,包含图片是非常有价值的。
临床诊断为XP的两名兄弟姐妹,一名20岁的女性(ID_4.19)和一名22岁的男性(ID_4.20)是近亲父母的第四个和第三个孩子(图1A)。他们生活在巴西北里奥格兰德州(Rio Grande do Norte)一个血缘关系密切、罕见遗传病高发的地区Seridó[7]。他们都在很小的时候就被诊断出皮肤癌,当时她13岁,他15岁,这在XP-E中并不常见。两人都接受了多次手术,以去除暴露在阳光下的皮肤损伤。患者ID_4.19切除了19个BCC和20个SCC,患者ID_4.20切除了10个BCC和25个SCC。两人都在23岁时被早期诊断为转移性黑色素瘤。
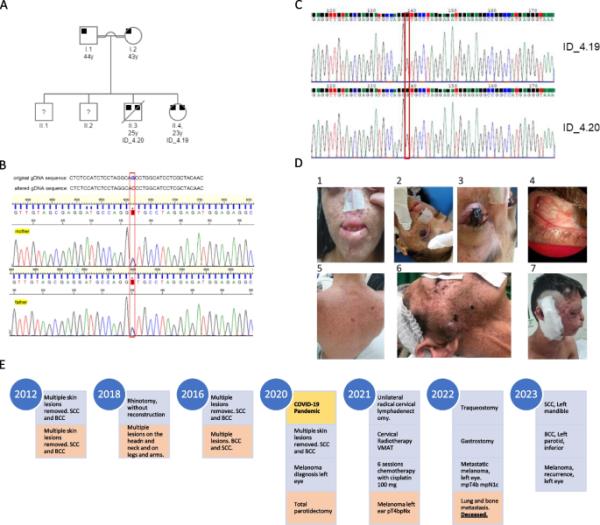
显示近亲婚姻的家庭系谱。NM_000107.3:c的双亲(I.1和I.2)都是杂合的。1027G > C和患者ID_4.19 (II.4)和患者ID_4.20 (II.3)是该变异的纯合子。两名年长的兄弟姐妹无症状,未接受检测。B兄弟姐妹的父亲和母亲的反向序列电泳图。NM_000107.3: c。1027G > C变体用红色突出显示。C . ID_4.19和ID_4.20的反序电泳图。D照片证明严重表型。患者ID_4.19照片来自运动,以消除病变的嘴唇,脸和鼻子。2和3。LE的结节状、色素沉着和升高的病变,延伸到整个角膜。4. 图片显示RE的黑色素瘤。患者ID_4.20照片显示被移除的病变和背部的色素沉着,暴露在阳光下。6. 右腮腺病变的外排照片,手术前和7。在腮腺全切除术后。E患者临床病史的里程碑,患者ID_4.19以蓝色突出显示,患者ID_4.20以橙色突出显示,不幸的是,他于12/06/2022去世
案例展示
- 1.
患者ID_4.19女,23岁(1999年出生)。未发现神经系统异常。她的皮肤在眼睑、面部和身体所有暴露在紫外线下的部位出现点状、扁平、色素沉着的病变。自2012年以来,她一直在头颈科接受随访,并切除了多处皮肤病变(表1)。2018年5月,她接受了鼻切开术,没有重建(图1C1)。双眼全角膜表面可见广泛的色素病变,右眼视力(RE)为20/100,左眼视力(LE)为视力障碍。她接受了LE角膜病变的切除活检,诊断为SCC,该色素病变升高,延伸到整个角膜,使得无法评估眼睛的内部结构(图1C2和1C3)。在过去的5年里,当她使用局部丝裂霉素治疗时,她的病变进行性增加,然而,她失去了随访,直到2020年,病变发展和LE视力丧失后才回来(图1C4)。她接受LE摘除手术,角膜活检结果为结节性黑色素瘤,brreslow厚度5.5 mm,有丝分裂指数4/ 1.0 mm2,存在溃疡。病理报告显示肿瘤切除边缘为游离/阴性。她的RE有鳞状细胞癌病变,她接受局部丝裂霉素治疗,并与眼科医生随访。在2019冠状病毒病大流行期间,她再次失去随访,并于2021年8月再次就诊,左侧眼球出现肿大、深色病变,呈眶外延伸,尺寸为4,9 × 2,8 × 3,4厘米。诊断为复发或残留黑色素瘤,她接受了额外的内脏切除手术。结节性黑色素瘤Breslow厚度30,0 mm, Clark 5,肿瘤浸润淋巴细胞(TIL)及溃疡存在,有丝分裂指数11/1,0 mm2。她接受放疗和顺铂100mg 6个周期的治疗,目前正在观察是否有新的病变,并由肿瘤科医生随访。
- 2.
患者ID_4.20男,25岁(1997年出生)。未发现神经系统异常。他暴露在紫外线下的部位出现多处病变,如背部(图1C5)、腿部、手臂和面部(耳朵、鼻子和嘴唇)。自2012年起,患者在头颈科接受随访,并切除了多个皮肤病变(表1)。2020年2月,患者行右侧腮腺全切除术,切除神经内分泌癌,类癌(图1C6和1C7)。他没有视力障碍。在2019冠状病毒病大流行期间,他失去了随访,并于2021年2月25岁时再次接受随访,左耳出现可疑病变,尺寸为1.7 × 0.8厘米。诊断为结节性黑色素瘤,直径8 0 mm,有丝分裂指数5/1 000 m2,有TIL和溃疡。免疫组化结果显示分期为pT4bpNx, Breslow厚度8,0 mm, Clark 5, IHC谱,S100+, MART-1+, p63-,细胞角蛋白-和EpCAM-。同时,甲状旁腺也有2个广泛病变(3,2 × 2,4 cm和2,2 × 1,8 cm),并延伸至颈部,伴右侧神经压迫和神经性疼痛。采用丁丙诺啡(5 mg)和普瑞巴林(75 mg)镇痛,制成星状神经节阻滞。2022年9月,CT图像分析显示肺及骨转移。患者曾接受顺铂治疗恶性黑色素瘤,由于毒性,其表现状态较差,于ICU行胃造口术和气管切开术,现接受姑息治疗。不幸的是,他于2022年6月12日去世。
诊断评估:基因分析
兄弟姐妹的手术病变组织保存在Allprotect®tissue Reagent (Qiagen)中,DNA提取使用dnasy Blood & tissue Kit (Qiagen)。使用Agilent SureSelect v6和BGISEQ500测序平台进行WES,覆盖范围达到50X,根据GATK最佳实践协议[8]使用GATK4识别突变。BCFtools/RoH命令[9]使用马尔可夫模型检测测序数据中的纯合子(RoH)运行数(参数:最小长度4 Mb;最小连续标记数= 10)。DNA是从父母的唾液中提取的。对于Sanger测序,我们使用了100 ng的DNA和XP-E引物,以及赛默飞世尔公司的Platinum™PCR SuperMix High Fidelity。考虑到基因组GRCh37.p13的版本,左侧引物从第49位开始,右侧引物从第232位开始。引物序列为Forward, GGGAGGCCAGCTAGGGATTA和Reverse, CTCACCGAACTGATGCCAGA。
在纯合性(RoH)序列中鉴定出一个123 Mb的区域,对应于基因组的4%,并确认了血缘关系(图2A)。DDB2基因(NM_000107)位于chr11 36 Mb ~ 61 Mb (chr11:47,236,525 ~ 47,260,768)。变异的质量得分较高,为4656.03,ID_4.19的覆盖率为127x, ID_4.20的覆盖率为38x。在这两例患者中,我们在DDB2 C. 1027g > C中发现了变异,在第8外显子chr11:47259391位置导致p.A343P氨基酸改变,因此NM_000107.3: C. 1027g > C。已知DDB2纯合错义变异体可引起E组色素性干皮病(MIM: 278,740)。该变异未在一般人群(1000Genomes[10]、dbSNP151[11]、GNOMAD[12])或疾病相关数据库CLINVAR[13]、LOVD[14]中发现。两例患者均携带一纯合变异,通过Sanger测序在其父母的杂合性中检测到相同的变异(图1A和B)。使用MCAP[15]和REVEL[16]工具进行识别疾病相关非同义单核苷酸变异的功能预测分析,得分分别为0.07和0.26,提示该变异可能具有致病性,但致病性评分不高。根据一个决策树模型,该模型测量并比较了四种已知突变预测因子和十七种监督机器学习算法的准确性,变体NM_000107.3:c。1027G > C具有致病性[17]。此外,位于第8外显子c.1027位的G在人类和其他原始人中高度保守(Altai Neandertal G/G;丹尼索瓦G / G;Vindijia穴居人G/G)。根据ACMG(美国医学遗传学学院)和AMP(分子病理学协会)指南[18],当一个基因已知与疾病相关时,多个家庭成员的变异分离支持致病性的证据。由于患者信息数据的隐私性,在合理要求后,通信作者可以提供WES数据。
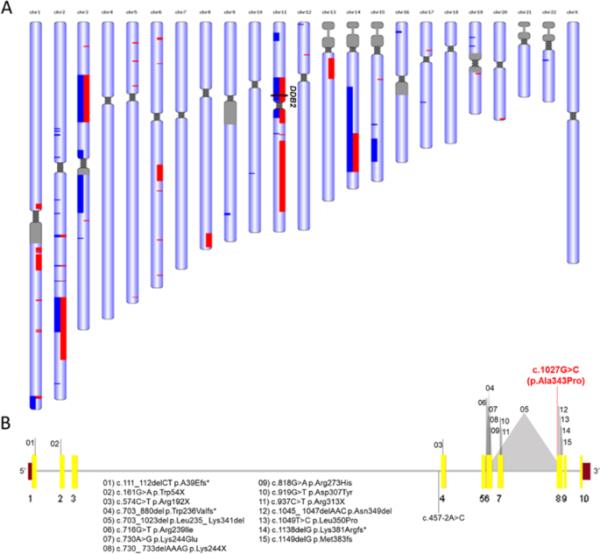
WES的遗传分析。1例XP-E患者在每条染色体上检测到ROH区域。蓝色和红色突出显示的区域分别是患者ID_4.20和患者ID_4.19中的ROH。B数据库中描述的DDB2基因示意图及致病变异和VUS。外显子为黄色,列出了在ClinVar上提交和文献中描述的所有变异(由Yang和同事审查,2020[26]),在两个兄弟姐妹中检测到的变异以红色突出显示
讨论与结论
在本文中,我们报告了两名来自巴西近亲家庭的XP-E患者,他们患有早发性多发性皮肤病变和恶性黑色素瘤。XP- e通常被描述为轻度XP表型,具有残留的光产物DNA修复水平(在50%至100%之间),这使得诊断困难,通常,直到成年才被诊断出来[19,20]。XP-E患者表型变异的原因可能与环境暴露和生活方式有关。在未确诊期间,他们积累了大量的癌前病变,因此,他们可能发展成数百种皮肤癌[21]。不幸的是,COVID-19大流行难以获得医疗保健[22],特别是在脆弱的农村地区,导致病变演变为黑色素瘤。
父母为杂合子,无症状,4个兄弟姐妹中的2个为纯合子,具有DDB2基因的C . 1027g > C (p.A343P)变体。在公共数据库的一般人群中没有发现这种变体。尽管新变异的致病性评分不是很高,但修饰的位置似乎对DDB2 dna结合功能极为重要。DDB2在人体组织中普遍存在,并先于XP-C定位修复DNA中的CPD和6- 4pp病变[6]。我们面临的一个重大挑战是基因组数据库中代表性不足的人群的数据有限,这种持续缺乏多样性给准确确定基因组变异的致病性带来了独特的困难。基因组变异的致病性通常通过将观察到的变异与数据库中编目的已知变异进行比较来评估。这些数据库主要由来自欧洲血统的个体的基因组数据组成,其他种族群体的代表性较小。因此,我们目前对变异致病性的理解大多偏重于欧洲人群。如果没有对不同人群的充分代表,我们可能会错过对变异致病性的关键见解,无法为来自代表性不足背景的个体提供准确的诊断、风险评估和量身定制的治疗计划。
在一项对89例XP患者的研究中,观察到XP- c组与XP- e和XP- v组相比有特殊的眼部问题倾向,而XP- e和XP- v组有更多的皮肤癌[23]。患者ID_4.19双眼病变,LE角膜结节性黑色素瘤,1年后病变残留/复发。由于鲜有报道,XP-E患者眼部问题的病因尚不清楚。
本报告介绍了生活在热带国家农村地区的患者的高紫外线发生率对XP-E结果的影响。在Serido地区,UVA/UVB发病率极高,因此增加了嘧啶二聚体的频率[24,25],加上这种环境风险,这些患者在COVID-19大流行期间失去了随访,这两个因素分别可以解释这2例患者在20岁和22岁时诊断为黑色素瘤的临床表现的预期和严重程度。
目录
摘要 背景 案例展示 讨论与结论 数据和材料的可用性 缩写 参考文献 致谢 作者信息 道德声明 搜索 导航 ##### 下载原文档:https://link.springer.com/content/pdf/10.1186/s12920-023-01622-8.pdf为您推荐:
- 2023年7月新游戏发布时间、日期和全部阵容 2024-05-11
- 戴安娜王妃在一封信中谈到了与查尔斯离婚后对未来的“恐惧” 2024-05-11
- 巴基斯坦人总理-土耳其的战略合作达到了友谊的新高度 2024-05-11
- 成千上万的人可能不必要地为养老金纳税 2024-05-11
- 当她祈祷时,她欣喜若狂,看到了她的守护天使谁是罗马的弗朗西斯- 2024-05-11
- 拜登任命杰夫·齐恩茨为下一任幕僚长 2024-05-11


